Page 17 - To jest chemia 6. Zbiór zadań
P. 17
4.2. Objętość molowa gazów – prawo Avogadra 123
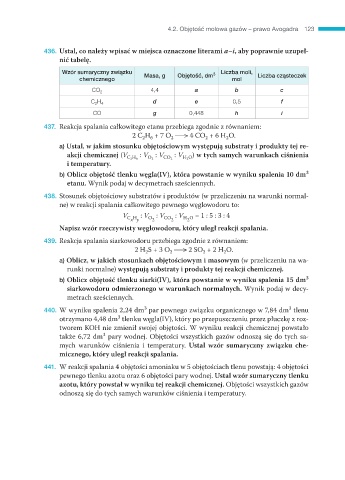
436. Ustal, co należy wpisać w miejsca oznaczone literami a–i, aby poprawnie uzupeł-
nić tabelę.
Wzór sumaryczny związku Masa, g Objętość, dm 3 Liczba moli, Liczba cząsteczek
chemicznego mol
4,4 a b c
CO 2
C 2 H 4 d e 0,5 f
CO g 0,448 h i
437. Reakcja spalania całkowitego etanu przebiega zgodnie z równaniem:
2 C H + 7 O 4 CO + 6 H O.
2
2
2
6
2
a) Ustal, w jakim stosunku objętościowym występują substraty i produkty tej re-
akcji chemicznej (V : V : V : V ) w tych samych warunkach ciśnienia
C 2 H 6 O 2 CO 2 H 2 O
i temperatury.
3
b) Oblicz objętość tlenku węgla(IV), która powstanie w wyniku spalenia 10 dm
etanu. Wynik podaj w decymetrach sześciennych.
438. Stosunek objętościowy substratów i produktów (w przeliczeniu na warunki normal-
ne) w reakcji spalania całkowitego pewnego węglowodoru to:
V C H : V : V CO 2 : V H O = 1 : 5 : 3 : 4
O
x y
2
2
Napisz wzór rzeczywisty węglowodoru, który uległ reakcji spalania.
439. Reakcja spalania siarkowodoru przebiega zgodnie z równaniem:
2 H S + 3 O 2 SO + 2 H O.
2
2
2
2
a) Oblicz, w jakich stosunkach objętościowym i masowym (w przeliczeniu na wa-
runki normalne) występują substraty i produkty tej reakcji chemicznej.
3
b) Oblicz objętość tlenku siarki(IV), która powstanie w wyniku spalenia 15 dm
siarkowodoru odmierzonego w warunkach normalnych. Wynik podaj w decy-
metrach sześciennych.
3
3
440. W wyniku spalenia 2,24 dm par pewnego związku organicznego w 7,84 dm tlenu
3
otrzymano 4,48 dm tlenku węgla(IV), który po przepuszczeniu przez płuczkę z roz-
tworem KOH nie zmienił swojej objętości. W wyniku reakcji chemicznej powstało
3
także 6,72 dm pary wodnej. Objętości wszystkich gazów odnoszą się do tych sa-
mych warunków ciśnienia i temperatury. Ustal wzór sumaryczny związku che-
micznego, który uległ reakcji spalania.
441. W reakcji spalania 4 objętości amoniaku w 5 objętościach tlenu powstają: 4 objętości
pewnego tlenku azotu oraz 6 objętości pary wodnej. Ustal wzór sumaryczny tlenku
azotu, który powstał w wyniku tej reakcji chemicznej. Objętości wszystkich gazów
odnoszą się do tych samych warunków ciśnienia i temperatury.